Tous les organismes vivants subissent des modifications génétiques. Elles sont en fait des erreurs dans le processus de réplication lors de la copie de l’ADN. Elles se produisent également sous l’effet d’agents mutagènes. Un brassage de gènes intervient lors de la reproduction sexuée, les enfants ne sont pas les clones de l’un ou l’autre des parents. Les OGM résultent d’une modification génétique volontaire et ciblée.
Lorsque l’Homme modifie le patrimoine génétique des organismes par des techniques de génétique moléculaire, il crée ce qu’on appelle des « organismes génétiquement modifiés » ou « OGM ». Ces techniques non naturelles modifient spécifiquement l’organisme soit par mutagenèse, un gène d’un organisme est modifié pour le réintroduire dans le même organisme ou de la même espèce, soit par transgenèse, un gène provenant d’un autre organisme est introduit. Les organismes modifiés par transgenèse sont très nombreux et appartiennent aux différents domaines du vivant ; citons les bactéries, les cellules eucaryotes en culture, mais aussi les organismes pluricellulaires comme les animaux et les plantes.
En France, l’introduction de gènes d’un organisme dans un autre par les techniques de biologie moléculaire est réglementée par la loi du 13 juillet 1992 précisée par un décret du 27 mars 1993 (93-774) et les expérimentateurs doivent obtenir, après déclaration de leur projet et des conditions de sécurité mises en œuvre, l’autorisation de la Commission Nationale de Génie Génétique.
Alors que les transformations génétiques de micro-organismes pour produire de l’insuline, de l’EPO ou de l’hormone de croissance ne soulèvent pas de problème dans l’opinion, la production de plantes génétiquement modifiées entraîne de vifs débats sur les conséquences pour les plantes, l’environnement, les animaux ou les humains ; se pose aussi la question de l’obtention des semences, des droits de mise sur le marché et leur utilisation.
Cet article est centré sur les techniques de modifications génétiques des plantes avec une description préalable d’une bactérie qui est à l’origine de ces techniques.
Ce sont des techniques sophistiquées de biologie moléculaire développées à partir des années 1970. Leur vulgarisation n’est pas aisée, cet article devrait y contribuer. Une meilleure compréhension du processus d’obtention des PGM devrait permettre au lecteur d’avoir une opinion éclairée par rapport aux débats sur les OGM.
Avant d’aborder la description des techniques de modification génétique, faisons un bref détour par la sélection des plantes.
La sélection des plantes
A partir du néolithique, les hommes ont commencé à sélectionner des plantes, le blé en Asie Mineure, le riz dans le sud-est de l’Asie, le maïs en Amérique Centrale. Cette sélection s’est faite en choisissant des variants très minoritaires, par exemple du blé et du riz avec des grains qui restent attachés à l’épi. Cette caractéristique est un avantage pour la récolte, la semence et la consommation. La sélection des plantes s’est poursuivie en recherchant des variants pour une meilleure production, de meilleures qualités gustatives, l’adaptation à différents sols et climats. Ce travail de sélection s’est progressivement organisé et fût l’œuvre des agriculteurs qui représentaient la grande majorité de la population. A la fin du 19ème siècle certains sont devenus des semenciers. Les modes de sélection ont eu alors pour objectif d’obtenir des variétés plus homogènes, voire uniformes et plus universelles.
La première révolution dans les concepts de sélection est la théorie de l’évolution (1859) de Charles DARWIN (1809-1882) : l’origine des espèces au moyen de la sélection naturelle. La deuxième avancée théorique est celle de Gregor MENDEL (1822-1884), avec le concept de gène. C’est à cette époque, en lien avec les débuts de l’industrialisation de l’agriculture que sont apparus les grands semenciers en France : Vilmorin, Clause et dans notre région Florimond Desprez. Cette spécialisation va se poursuivre et se renforcer jusqu’au milieu du 20ième siècle puis de plus grandes entreprises comme Limagrin et un établissement public de recherche, l’INRA (Institut National de la Recherche Agronomique), vont contribuer aux développements des recherches et de la sélection de nouvelles variétés. Après la première guerre mondiale, les critères de sélection ont évolué en lien avec les modes de cultures : augmentation des rendements par l’utilisation des engrais de synthèse. Les nouvelles variétés obtenues, qui produisent plus, sont aussi plus fragiles et demandent une utilisation plus importante de fongicides et autres produits phytosanitaires. Le développement des produits phytosanitaires et les avancées dans les biotechnologies ont favorisé l’arrivée des groupes de l’industrie chimique comme Monsanto, Pionnier, Syngena dans la sélection et la production de semences génétiquement modifiées.
Une autre approche a précédé les PGM c’est celle des hybrides F1. C’est à partir de lignées « pures » que s’est développée la technique des hybrides F1 qui permet d’obtenir des plantes ayant des caractéristiques intéressantes provenant des deux variétés parentales. Technique d’autant plus aisée quand les fleurs mâles et femelles sont séparées, comme pour le maïs, mais plus difficile dans le cas contraire où on a recours à la stérilisation mâle, par voie chimique, pour l’une des variétés, stérilité aussi possible pour les PGM. L’inconvénient majeur des hybrides est la dissémination des caractères génétiques à la deuxième génération et donc pour l’agriculteur l’impossibilité de réutiliser ses propres semences.
La sélection et la production de semences sont ainsi passées, en deux siècles, de l’artisanat à l’industrie avec pour corollaire la division du travail. En effet, l’obtention de plantes génétiquement modifiées nécessite l’intervention d’un grand nombre de compétences techniques ; les chercheurs sont devenus des maillons dans la chaîne de la production scientifique. Cette évolution que l’on retrouve dans tous les domaines de la recherche est marquée par la perte de contrôle et de décision des chercheurs.
Comment obtient-on des plantes génétiquement modifiées ?
La technique d’obtention la plus courante est la transgenèse, on ajoute un nouveau gène dans un organisme grâce à la bactérie du sol l’Agrobacterium tumefaciens. Cette bactérie provoque une maladie : la galle du collet, maladie connue depuis l’antiquité qui se manifeste par la présence de nodules appelés galles au niveau du collet des plantes (Figure 1). L’interaction Agrobacterium-plante est une manipulation génétique naturelle au cours de laquelle la bactérie détourne à son profit l’activité métabolique de la plante.
De la maladie de la galle aux plantes transgéniques
En 1907, à partir de fragments de galle développée sur une plante, deux chercheurs américains ont isolé l’agent pathogène : la bactérie Agrobacterium tumefaciens.
En 1941, deux autres chercheurs américains, ont démontré que les cellules issues de galles du collet sont des cellules cancéreuses. En effet, même en absence d’Agrobacterium elles prolifèrent facilement et indéfiniment sur des milieux de culture dépourvus de facteurs de croissance, milieux qui ne permettent pas la croissance de cellules saines (Figure 2). Les chercheurs en déduisent l’existence d’un principe inducteur de tumeur. 
Agrobacterium tumefaciens.
A la fin des années 1950, deux groupes de chercheurs français identifient des composés spécifiques des cellules de galle, les opines*. En 1972, ils proposent que la synthèse des opines résulte d’un transfert d’informations génétiques entre la bactérie et la plante. En 1974, l’élément génétique responsable du pouvoir pathogène chez A. tumefaciens est caractérisé par un consortium de chercheurs belges. Il s’agit d’un fragment d’un plasmide*1, appelé plasmide Ti (tumor-inducing) ou pTi. Un plasmide est un ADN circulaire capable de se répliquer de manière autonome et sans intégration dans l’ADN chromosomique d’une bactérie. En 1977, un consortium américain, démontre que la pathologie de la galle résulte du transfert d’un fragment d’ADN du pTi, appelé ADN-T de la bactérie vers les chromosomes de la cellule végétale (Figure 3). Enfin, dès 1978, le consortium belge cité ci-dessus est le premier à proposer que le plasmide Ti pourrait servir de vecteur d’introduction de séquences d’ADN choisies dans le génome végétal, ouvrant ainsi la voie au génie génétique des plantes et à la création de variétés OGM.
Le mode d’action d’Agrobacterium tumefaciens en milieu naturel
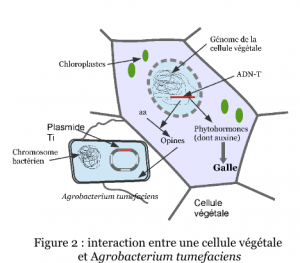 Un végétal blessé émet des composés phénoliques bactériostatiques qui attirent Agrobacterium vers le site de la blessure et permet l’adhésion de la bactérie aux cellules végétales. Agrobacterium met alors en place un système de transfert d’un fragment de son ADN vers la cellule blessée dit ADN-T porté par le plasmide Ti qui s’intègre au génome nucléaire de la cellule végétale. Les gènes portés par l’ADN-T s’expriment dans le végétal et conduisent à la synthèse :
Un végétal blessé émet des composés phénoliques bactériostatiques qui attirent Agrobacterium vers le site de la blessure et permet l’adhésion de la bactérie aux cellules végétales. Agrobacterium met alors en place un système de transfert d’un fragment de son ADN vers la cellule blessée dit ADN-T porté par le plasmide Ti qui s’intègre au génome nucléaire de la cellule végétale. Les gènes portés par l’ADN-T s’expriment dans le végétal et conduisent à la synthèse :
de deux phytohormones* : l’auxine, hormone de croissance et une cytokine, dont la surproduction entraîne une multiplication anarchique des cellules végétales ;
de composés absents habituellement de la cellule végétale, des opines. Les opines peuvent induire le transfert du plasmide Ti d’une agrobactérie vers une autre par conjugaison génétique. Ce sont donc des médiateurs chimiques clefs de l’interaction Agrobacterium-plante, dont la présence dans la tumeur favorise la croissance des pathogènes et concoure à leur dissémination.
L’utilisation de pTi en transgenèse
Le génie génétique végétal repose en grande partie sur l’utilisation du plasmide Ti, qui ne porte plus les gènes responsables du pouvoir pathogène. Sur ces plasmides, les gènes tumoraux sont en effet remplacés par un (ou plusieurs) gène(s) d’intérêt agronomique et par un gène marqueur permettant de sélectionner les cellules transformées. Si le gène utilisé provient d’une bactérie, un intron* sera inséré soit entre le promoteur et la phase ouverte de lecture* (ORF) soit en aval de celle-ci. 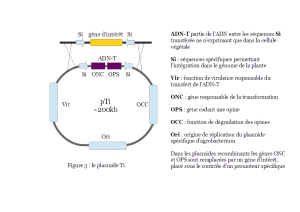 Pour un gène d’un organisme eucaryote, l’ADN complémentaire sera inséré de la même manière. Dans tous les cas, le gène d’intérêt sera placé sous le contrôle d’un promoteur spécifique des plantes. Plusieurs techniques basées sur le mode d’action naturelle existent pour transformer une plante à l’aide d’A. tumefaciens :
Pour un gène d’un organisme eucaryote, l’ADN complémentaire sera inséré de la même manière. Dans tous les cas, le gène d’intérêt sera placé sous le contrôle d’un promoteur spécifique des plantes. Plusieurs techniques basées sur le mode d’action naturelle existent pour transformer une plante à l’aide d’A. tumefaciens :
La bactérie peut être infiltrée dans les feuilles ou pénétrer au niveau d’une blessure.
Le trempage des fleurs dans une solution d’A. tumefaciens. Cette méthode présente l’intérêt d’intégrer le transgène dans les cellules germinales (pollen et ovules) et donc d’obtenir une descendance transgénique.
La transformation de cellules végétales indifférenciées en culture (« cals ») par A. tumefaciens. Il faut ensuite générer des plantes à partir de ces cals. Les cellules sont multipliées in vitro sur des milieux de culture puis des plantes entières sont générées par des techniques classiques (Figure 4).
Les principaux transgènes utilisés en agriculture.
Plusieurs types de transgènes peuvent être transférés par l’intermédiaire du plasmide Ti.
Gène de résistance à un herbicide.
En grande culture, comme en culture maraîchère, pour faciliter la croissance des végétaux on élimine les plantes indésirables, ou adventices, en utilisant un herbicide dit spécifique. Ces herbicides affectent le moins possible la croissance des plantes d’intérêt et sont adaptés à chaque type de plantes. L’utilisation d’un seul herbicide pour toutes les cultures pourrait réduire les coûts. Pour ce faire, il est nécessaire que toutes les plantes de culture soient résistantes à cet herbicide. Ceci est possible par l’introduction d’un gène de résistance à cet herbicide systémique. Le produit de ce gène, généralement une enzyme, inactive l’herbicide dans la plante de culture. Pour cela, il existe plusieurs possibilités : modifier l’herbicide par addition d’un radical, le dégrader en plusieurs molécules inactives, empêcher son entrée dans les cellules.
L’herbicide ne se retrouve pas dans les plantes résistantes après culture car, par exemple, elles le dégradent en deux molécules inactives pour résister.
Le gène le plus ancien et le plus connu est celui qui confère aux plantes la résistance au glyphosate, substance active du Roundup. Le glyphosate est composé d’un acide organique faible, analogue à un acide aminé, la glycine, doté d’un groupement phosphonate. Pour accroître sa solubilité et son passage dans la plante, les industriels le préparent souvent sous forme de sel d’isopropylamine (Roundup). Des additifs, tensio-actifs, lui sont ajoutés pour le fixer sur les plantes. Le mécanisme d’action du glyphosate n’est pas totalement élucidé, il interviendrait, principalement, en inhibant l’enzyme 5-enol-pyruvoyl-shikimate-3-phosphate synthase (EPSPS) impliquée dans une voie métabolique nécessaire pour la synthèse des acides aminés aromatiques tels que la phénylalanine, la tyrosine et le tryptophane. Cette synthèse se fait uniquement dans les organismes autotrophes*.
Le gène de résistance est une version mutée de la 5-enol-pyruvyl-shikimate-3-phosphate synthase, EPSPS. L’enzyme est normalement affectée par le glyphosate mais sa version mutante, 2mEPSPS, l’hydrolyse. En effet le glyphosate est clivé, son principal produit de dégradation est l’AMPA ou acide aminométhylphosphonique, résultant de la perte du groupe acétate (voir figure). Le variant génétique est présent chez des bactéries et certaines variétés de maïs, qui sont donc naturellement résistantes au Roundup.
De nombreuses espèces végétales ont été modifiées pour devenir résistantes, les plus cultivées sont : le maïs, le soja, le coton, …. Le maïs génétiquement modifié représente 30% des cultures (Brésil, USA,..) et 82% pour le soja. En Europe, peu de pays autorisent ces cultures à l’exception de l’Espagne. Le tableau présente les surfaces cultivées dans le monde par pays et indique le type de culture.
Superficies mondiales des cultures de PGM en 2014 par pays.
|
Rang |
Pays |
Superficie en millions hectares |
% des surfaces cultivées |
Plantes GM |
|
1 |
USA |
73,1 |
40,3 |
Maïs, Soja, Coton, Colza, Betterave sucrière, Luzerne, Papaye, Courge |
|
2 |
Brésil |
42,2 |
23,3 |
Soja, Maïs, Coton |
|
3 |
Argentine |
24,3 |
13,4 |
Soja, Maïs, Coton |
|
4 |
Inde |
11,6 |
6,4 |
Coton |
|
5 |
Canada |
3,9 |
6,4 |
Colza, Maïs, Soja, Betterave sucrière |
|
6 |
Chine |
3,9 |
2,1 |
Coton, Papaye, Peuplier, Tomate, Poivron |
|
7 |
Paraguay |
2,9 |
2,1 |
Soja, Maïs, Coton |
|
8 |
Pakistan |
2,7 |
1,6 |
Coton |
|
9 |
Afrique du Sud |
1,6 |
1,5 |
Maïs, Soja, Coton |
|
10 |
Uruguay |
1 |
0,9 |
Soja, Maïs |
98% des cultures PGM sont effectuées dans ces 10 pays, les 2% restants sont cultivés par les 18 pays suivants (en ordre décroissant de superficie) : Bolivie, Philippines, Australie, Burkina Faso, Birmanie, Mexique, Espagne, Colombie, Soudan, Honduras, Chili, Portugal, Cuba, République tchèque, Roumanie, Slovaquie, Costa Rica et Bangladesh. Cependant, 98 % de la superficie mondiale cultivée en PGM (181,5 millions d’hectares) se retrouve dans seulement dix pays. Adapté de http://www.ogm.gouv.qc.ca/ogm_chiffres/principales_cultures.html
Gène qui permet la synthèse d’une molécule toxique dite « pesticide »
La pyrale du maïs, Ostrinia nubilalis, et la sésamie, Sesamia nonagrioides, sont deux papillons ravageurs du maïs très courants en Europe et en Amérique du Nord. La chenille creuse des galeries dans les tiges. Il existe au moins trois possibilités pour lutter contre ses ravageurs :
- le traitement par des pesticides de synthèse comme la deltamétrime, proposé par Bayer, c’est un composé chimique de la famille des pyréthrinoïdes ayant des propriétés neurotoxiques ;
- l’utilisation depuis 1959 notamment en agriculture biologique, d’extrait de la bactérie Bacillus thuringiensis qui produit des toxines dont une est active contre ces ravageurs ;
- la modification du maïs pour l’expression d’une protéine toxique issue de la bactérie Bacillus thuringiensis. La protéine toxique est le produit du gène Cry1Ab introduit par l’intermédiaire du plasmide PV-ZMCT01 dans l’ADN du maïs. Le prototype de ce type de modification est le maïs Bt (Monsanto 810). Le terme Bt fait référence à la bactérie Bacillus thuringiensis. La protéine toxique agit en se fixant à des récepteurs spécifiques de l’épithélium intestinal des chenilles et provoque une paralysie intestinale, ce qui entraîne la mort de la chenille.
La protéine ne semble pas être toxique pour d’autres espèces d’insectes. Cette modification peut-être accompagnée d’autres comme la résistance à un herbicide.
L’extrait de la bactérie Bacillus thuringiensis est rapidement dégradée contrairement aux pesticides de synthèse, qui ont un spectre d’action de plus en plus un large. Dans le cas du maïs modifié, la protéine toxique est exprimée pendant tout le cycle végétal même quand sa présence n’est pas nécessaire et reste présente dans la plante mature, principalement dans les tiges et les feuilles mais sera facilement dégradée comme toutes les protéines lors de l’alimentation des animaux.
Comme pour tout traitement, il peut apparaître des résistants. Pour ralentir l’apparition de ces résistances, la législation impose de cultiver en parallèle des parcelles ensemencées avec des semences non-OGM (20% de surface). Ces zones dites refuges accueillent des pyrales sensibles à la toxine et qui peuvent se croiser avec leurs éventuels voisins résistants ce qui produit alors des hybrides qui sont tués quand ils choisissent de pondre sur le maïs Bt. Toutefois, il faut souligner que cette précaution apparente a été formulée par l’administration nord-américaine et transposée en Europe contre l’expertise scientifique de plusieurs organismes qui préconisaient généralement des zones refuges de plus grandes dimensions, et ce particulièrement si ces zones refuges doivent recevoir un traitement insecticide classique. Une autre solution pour éviter l’apparition de résistants est de limiter les monocultures et de recourir à la rotation des cultures, rotation qui permet de casser le cycle de vie de la pyrale.
Gène qui permet la synthèse d’une protéine
La protéine peut avoir un intérêt pour la plante ou être une enzyme active dans la plante. Par exemple, la modification de la couleur de la fleur d’œillet, Dianthus caryophyllus est un intérêt pour la plante. La couleur des fleurs est généralement le résultat de la concentration relative de deux types de pigments : les caroténoïdes et principalement les flavonoïdes dont les anthocyanes. Il y a trois groupes d’anthocyanes, ceux à base de delphinidine qui produisent généralement une couleur bleue, de cyanidine qui produisent une couleur rouge ou rose, de pélargonidine qui produisent la couleur orange ou brique. Les œillets non génétiquement modifiés de dominante cerise, ne possèdent pas la voie de biosynthèse d’anthocyanine et donc de delphinidine. La modification génétique consiste à introduire quatre gènes qui favorisent la production de delphinidine et conduit à un changement de couleur de la fleur vers le pourpre. Le gène codant la delphinidine provient du pétunia et a été introduit à l’aide d’A. tumefaciens.
Un autre exemple est l’enrichissement du maïs en lysine par l’introduction d’une voie de synthèse. La lysine améliore la valeur nutritive du maïs. Monsanto a développé le maïs LY038. La concentration finale en lysine est régulée au niveau de la première étape de sa voie de biosynthèse. L’introduction d’un gène peu sensible à la concentration en lysine permet d’accroître celle-ci. L’introduction du gène cordapA de la bactérie Corynebacterium glutamicum, permet l’expression de la dihydrodipicolinate synthase (cDHDPS) principalement dans les grains de maïs, car le gène est sous le contrôle du promoteur du gène Glb1, gène spécifique des grains. L’enzyme catalyse la condensation de la L-aspartate-4-semialdehyde et du pyruvate en 2,3dihydrodipicolinate qui est convertie en lysine par une série de réactions enzymatiques. Contrairement à l’enzyme de maïs DHDPS celle de Corynebacterium glutamicum est beaucoup moins sensible, permettant ainsi une accumulation de lysine libre, principalement dans les grains de maïs.
Ces grains de maïs sont utilisés comme ingrédient dans l’alimentation des animaux, principalement les poulets, les dindes et les porcs.
Gène qui code un ARN anti-sens
Un ARN anti-sens inhibe l’expression d’un gène par un mécanisme naturel appelé RISC (RNA induced silencing complex). La molécule d’ARN double brin (ARNdb) sera dégradée par une RNaseIII, nommée Dicer. Ce système existe dans la plupart des cellules eucaryotes*. C’est un mécanisme dénommé gene silencing. Il constitue une défense contre les infections par les virus à ARN.
Un ARN anti-sens est utilisé pour modifier la composition en amidon des pommes de terre de variétés féculières, différentes des pommes de terre de consommation. L’amidon est un mélange de deux polysaccharides homopolymères, l’amylose et l’amylopectine. Le ratio entre l’amylose et l’amylopectine dépend de la source botanique de l’amidon. Plusieurs enzymes participent à la synthèse de ces deux homopolymères qui diffèrent par leur degré de branchement et leur degré de polymérisation.
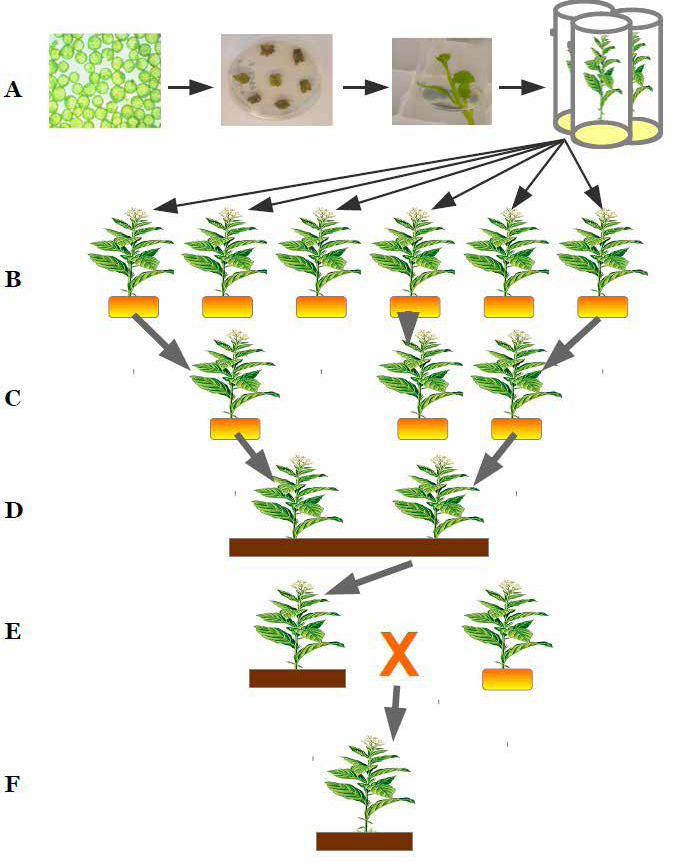
Les différentes étapes de l’obtention d’une variété PGM
A) In vitro : introduction d’un gène d’intérêt dans des cellules d’une plante à l’aide de la bactérie Agrobacterium
tumefaciens, des cals se forment et ils donnent naissance à des plantes.
B) En serre : mise en culture des plantes après transformation.
C) Caractérisation moléculaire et biochimique des plantes transformées.
D) Mise en culture et évaluation de la valeur agronomique de la plante.
E) Croisement avec une lignée commerciale.
F) Obtention d’une plante GM.
Pour certaines utilisations, par exemple la fabrication de papier, il est nécessaire de séparer ces deux polymères. Dans ce cas, un amidon enrichi en amylopectine est un avantage. La variété Amflora, de la société BASF Plant Science, a été conçue pour cela. La nouvelle variété de pomme de terre, qui dérive de la variété féculière Prevalent1, a un amidon dont la teneur en amylose est fortement réduite. La synthèse de l’amylose par polymérisation de dextrose est réalisée par une enzyme appelée GBSS (Granule Bound Starch Synthase). L’expression d’un ARN anti-sens permet d’inhiber la synthèse de la GBSS et donc celle de l’amylose. La modification génétique a été introduite à l’aide d’Agrobacterium tumefaciens.
Ces quatre types de modifications précédemment décrites peuvent être combinées. Ces combinaisons peuvent être obtenues principalement de deux manières : directement par l’insertion de plusieurs gènes ou par croisement entre deux plantes préalablement modifiées. Les plantes ayant plusieurs modifications représentent 28% des cultures des PGM dans le monde dont 75% du maïs aux USA. Le tableau 2 présente les demandes d’agrément pour 150 variétés auprès de la Commission Européenne, soit pour la culture, soit pour l’importation. Ces demandes ne sont qu’une infime partie des plantes génétiquement modifiées obtenues par les principales firmes comme Monsanto, Syngenta, Pionnier, Bayer, etc . Des noubeaux projets concernent notamment :
- l’abolition d’un récepteur de virus,
- l’enrichissement d’une plante pour la nourriture,
- la résistance à des conditions climatiques et/ou de sol extrêmes (sécheresse, salinité, …)
- la diminution de l’expression de l’éthylène pour ralentir la maturité des fruits.
Demande d’agrément pour la culture et/ou l’importation en Europe de PGM.
|
Herbicides |
Résistance insectes |
Composition modifiée |
Herbicides + résistance insecte |
Herbicides + composition modifiée |
Stérilité mâle |
Résistance insectes + composition modifiée |
Total |
|
|
Maïs |
11 |
18 |
3 |
40 |
2 |
74 |
||
|
Coton |
7 |
4 |
11 |
22 |
||||
|
Colza |
7 |
5 |
15 |
|||||
|
Riz |
1 |
1 |
||||||
|
Soja |
15 |
3 |
2 |
1 |
4 |
25 |
||
|
Betterave |
2 |
2 |
||||||
|
Pomme de terre |
1 |
4 |
5 |
|||||
|
Fleurs |
3 |
6 |
9 |
|||||
|
Total |
46 |
26 |
15 |
52 |
4 |
5 |
2 |
150 |
Compilation de données à partir du site : http://www.gmo-compass.org/eng/gmo/db/ (juillet 2015). Les demandes sont déposées par un pays membre de l’UE, elles sont ensuite examinées par l’EFSA qui émet un avis puis chaque pays autorise ou non.
Questions à propos des PGM.
De nombreuses questions se posent. Il est impossible d’établir une règle générale, chaque PGM est un cas particulier. Il est nécessaire donc de spécifier la(es) plante(s) de référence et les modes de culture. Ainsi un maïs résistant au glyphosate en grande culture industrielle doit être comparé à un maïs non résistant mais pour lequel un traitement par un herbicide en début de culture sera requis, herbicide qui présentera des propriétés de toxicologie de même ordre que le Roundup. De même pour le maïs Bt, la comparaison doit se faire avec des cultures de maïs traitées par des pesticides de synthèse. L’apparition de résistants, plantes adventices et insectes est inévitable, car il y a toujours des variants génétiques, qui sont sélectionnés par les traitements. Une rotation pluriannuelle des cultures permet de réduire de manière importante ces apparitions.
Le risque souvent évoqué, de dissémination des gènes introduits dans les PGM vers d’autres espèces, fait partie des fantasmes car les croisements entre espèces sont très rares voire inexistants. La dissémination vers une plante sauvage de la même espèce, n’est pas possible car les plantes PGM sont cultivées dans des zones où elles ne rencontrent pas la même plante à l’état sauvage.
Dans les constructions génétiques actuelles, il n’y a plus de gène de résistance à un antibiotique, ces gènes de résistance utilisés dans les étapes intermédiaires sont éliminés lors de la génération des plantes, notamment par le système CRE/LOX*. Mais même ce risque était un fantasme, la probabilité pour qu’un gène de résistance à un antibiotique passe du génome d’une plante à une bactérie pathogène est infinitésimale par rapport à l’utilisation inconsidérée des antibiotiques en médecine humaine et dans l’alimentation des animaux d’élevage.
L’introduction de gène d’un autre organisme dans une plante peut-elle avoir un effet sur la biologie de celle-ci ? Au niveau de l’ADN la réponse est clairement non, même si l’intégration se fait de manière aléatoire, mais suite à cette intégration, il y a un long travail de sélection et seules sont conservées les variants ne présentant pas d’altération dans l’expression des gènes (ARNm et protéines). Le produit, protéine/enzyme, du gène introduit peut-il avoir un effet ? C’est la seule question et la réponse dépend strictement de celui-ci.
Récemment, le Centre International de Recherche sur le Cancer (CIRC) a reclassé le Roundup dans la catégorie 2A, probablement cancérigène pour l’homme. Dans cette classe, on retrouve par exemple le trichloréthylène. Cette classification a pour but de mettre en garde sur les précaution à prendre lors de la manipulation de ces produits.
La production de PGM participe à la réduction de la biodiversité. En effet, la sélection des plantes cultivées a donné naissance à une très grande variété de lignées, liée aux conditions de sols, de climat, de modes de culture. Mais l’industrialisation de cette sélection, depuis le début du 20ème siècle a réduit le nombre de cultivars autorisés. Ce phénomène est accentué par l’obtention des PGM, en particulier par la réduction du nombre d’entreprises obtenant ces cultivars et l’optimisation des profits.
Le problème peut-être le plus important est la dépendance des agriculteurs vis à vis des firmes de semences. Ce phénomène n’est pas nouveau, il était déjà vrai pour toutes les semences certifiées. Il ne s’agit pas d’un problème technique, les agriculteurs peuvent très facilement reproduire ces semences, surtout si il y a un marqueur de résistance, à un herbicide par exemple. Ce sont d’ailleurs des agriculteurs, sélectionnés par les firmes de semences, qui les produisent en quantité. La non-reproduction des semences directement par les agriculteurs est le résultat d’une protection économico/politique des industriels des semences.
Par rapport à la sélection des semences, un mouvement de résistance se développe : les semences paysannes. Il s’agit d’un échange de graines entre producteurs organisé par la Confédération Paysanne qui a pour but de diversifier les productions pour une meilleure adaptation aux conditions de culture et aux demandes des consommateurs.
Pour conclure, l’obtention de plantes génétiquement modifiées est l’aboutissement actuel de la sélection des plantes, entamée au néolithique, qui s’est accélérée au cours de la première révolution industrielle, amplifiée pendant la seconde avec l’apparition des engrais de synthèse et des produits phytosanitaires tous deux issus du pétrole. Cette étape préfigure-t-elle une nouvelle révolution industrielle en concurrence avec les semences paysannes à l’image des Microsoft et autres Apple face aux logiciels en Open Source ?
Mécanisme d’action du glyphosate.
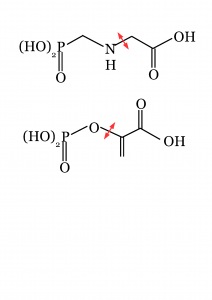 Le gène de résistance au glyphosate est une version muté de la 5-enol-pyruvyl-shikimate-3-phosphate synthase, EPSPS. L’enzyme est normalement affectée par le glyphosate mais sa version mutante, 2mEPSPS, l’hydrolyse. En effet le glyphosate est clivé, son principal produit de dégradation est l’AMPA ou acide aminométhylphosphonique, résultant de la perte du groupe acétate.
Le gène de résistance au glyphosate est une version muté de la 5-enol-pyruvyl-shikimate-3-phosphate synthase, EPSPS. L’enzyme est normalement affectée par le glyphosate mais sa version mutante, 2mEPSPS, l’hydrolyse. En effet le glyphosate est clivé, son principal produit de dégradation est l’AMPA ou acide aminométhylphosphonique, résultant de la perte du groupe acétate.
La 5-enolpyruvylshikimate-3-phosphate (EPSP) synthase est une enzyme qui catalyse la réaction : phosphoenolpyruvate + 3-phosphoshikimate ⇔ phosphate + 5-enolpyruvylshikimate-3-phosphate (EPSP). Le glyphosate agit comme un inhibiteur compétiteur de l ‘un des substrat, le phosphoenolpyruvate.
Glossaire
Les eucaryotes (du grec eu, bien et karuon, noyau) regroupe tous les organismes uni- ou pluricellulaires qui se caractérisent par la présence d’un noyau dans leurs cellules.
Un plasmide est un ADN circulaire bicaténaire capable de se répliquer de manière autonome et sans intégration dans l’ADN chromosomique d’une bactérie. Il peut posséder un gène de résistance à un antibiotique.
Les introns sont des séquences supprimées de l’ARN prémessager pour donner naissance à l’ARNm par un mécanisme complexe appelé épissage. Cette maturation des ARN est indispensable pour un transfert efficace des ARN du noyau vers le cytoplasme.
ORF, open reading frame, phase ouverte de lecture : séquence d’un ARNm qui s’étend du codon d’initiation de la traduction (AUG) à un codon stop (UAG, UGA, UAA)
Autotrophe, se dit d’un organisme capable de se multiplier en utilisant uniquement des éléments minéraux. Les bactéries et les plantes chlorophylliennes sont autotrophes contrairement aux animaux qui sont hétérotrophes.
Système CRE/LOX, issu du bactériophage P2. L’enzyme CRE circularise le fragment d’ADN compris entre deux séquences LOX. Cet ADN circulaire est éliminé au cours des divisions cellulaires.
Les opines sont des composés spécifiques d’une tumeur végétale, comme la galle du collet ou le broussin de vigne, induite par des bactéries pathogènes du genre Agrobacterium. Elles sont utilisées par la bactérie comme source d’azote et d’énergie.
Une phytohormone, ou hormone végétale, est une hormone produite par une plante. C’est une substance chimique organique qui régule la croissance végétale et/ou qui intervient entre des végétaux différents.
Bibliographie ou pour en savoir plus :
Une approche historique de la biologie moléculaire : Michel MORANGE, Histoire de la Biologie Moléculaire, La Découverte, Paris, 2003.
Une histoire récente de la sélection des semences : Christophe BONNEUIL et Frédéric THOMAS, Gènes, pouvoirs et profits. Recherche publique et régimes de production des savoirs de Mendel aux OGM, Quae éditions, 2009.
sur les OGM : Frédéric DENHEZ, OGM, le vrai du faux, Delachaux et Niestlé, Lausanne 2013.
Les textes réglementaires et la classification des manipulations génétiques : http://www.cnrs.fr/infoslabos/reglementation/CGGrecommand.htm
Un site général sur les PGM :
http://www.ogm.gouv.qc.ca/information_generale/info_ogm/info_vegetaux.html
Les plantes autorisées à la culture et/ou à l’importation dans l’Union Européenne : http://www.gmo-compass.org/eng/gmo/db/
Les surfaces agricoles cultivées en PGM dans le monde : http://www.ogm.gouv.qc.ca/ogm_chiffres/principales_cultures.html

wow, article bien taillé. merci